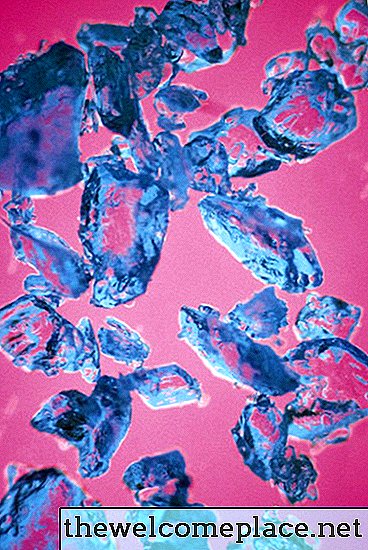
Nagu paljud siirdemetallide kompleksid, on ka vask (II) sulfaatpentahüdraat erksavärviline; selle kauni aine kristallid on kahvatu sinise tooni. Selle värvus tuleneb selle koostise keemiast ja füüsikast - või täpsemalt sellest, milliseid sidemeid see moodustab vase külge kinnitatud sulfaatioonide ja veemolekulidega.
 Vasksulfaatpentahüdraadil on ilus poolläbipaistev sinine värv.
Vasksulfaatpentahüdraadil on ilus poolläbipaistev sinine värv.Orbitaalid
Elektronidel on laineosakeste duaalsus, mis tähendab, et neil on nii laine- kui ka osakeselaadsed omadused. Elektroni käitumist aatomis kirjeldatakse lainekujulise võrrandiga, mida nimetatakse lainefunktsiooniks. Lainefunktsiooni ruut annab tõenäosuse, et elektron leitakse igal ajahetkel ühes konkreetses punktis. Elektronide lainefunktsioone aatomites nimetatakse ka aatomorbitaalideks. Keemikud nimetavad aatomorbitaalid, kasutades orbiidi energiataseme tähistamiseks numbrit, millele järgneb täht, mis tähistab orbitaali tüüpi. Perioodilise tabeli neljanda perioodi või uuema elemendi puhul peate keskenduma ainult kolme tüüpi orbitaalidele, nimelt s, p ja d. Nende orbitaalide kuju tundmaõppimiseks vaadake ressursside jaotises olevat linki.
Kristallvälja lõhenemine
Vase (II) sulfaadis olev vaseioon on kaotanud kaks elektroni, nii et sellel on +2 laeng. Selle äärepoolseimas energiatasandis või kestades on üheksa elektroni; need niinimetatud valentselektronid hõivavad kõik 3D orbitaale. Veemolekulid ja sulfaatioonid tõmbuvad ligi vase ioonile positiivse laengu abil, nii et nad lähenevad sellele ja paiknevad selle ümber oktaedrilises konfiguratsioonis. Järelikult kaks vaseioonide viiest 3D-orbitaalist joonduvad telgedel, mille võrra sulfaatioonid ja veemolekulid lähenevad; kuna nendes orbitaalides olevatel elektronidel ja molekulides / ioonidel olevatel elektronidel on negatiivne laeng, tõrjuvad nad üksteist. Lõppkokkuvõttes on kahel viiest 3D-orbitaalist energia suurenenud; neid nimetatakse nt orbitaalideks. Ülejäänud kolmel on seevastu energia vähenenud ja neid nimetatakse t2g-i orbitaalideks.
Valguse neeldumine
Koordinatsioonikompleks neelab valguse footoni, kui selle energia on võrdne elektri hõivatud oleku ja mõne muu saadaoleva oleku energia erinevusega. Järelikult suudab vasksulfaatkompleks absorbeerida valguse footoneid energiaga, mis on võrdne energia erinevusega t2g ja nt orbitaalide vahel. Nagu juhtub, võrdub vasksulfaatkompleksi energia erinevus spektri punase-oranži piirkonna valguse footonite energia erinevusega. Kuna sinise valguse edastamisel imendub punakas valgus, siis vasksulfaat on sinine.
Lahustub vees
Kui vasksulfaat lahustub vees, dissotsieeruvad vase- ja sulfaatioonid. Nüüd moodustab vaseioon ioon-oktaarse kompleksi, kus seda ümbritsevad kuus molekuli vett. Efekt on siiski endiselt sama, sest jaotus t2g orbitaalide ja nt orbitaalide vahel selles uues kompleksis on endiselt selline, et punakasoranž valgus heidab ja näete sinist värvi lahendust.